آیا تا به حال شده است که یک بطری آب را چند ساعت زیر آفتاب داغ بگذارید و هنگام بازکردن آن صدای خش خش کمی شنیده باشید؟ این به دلیل اصلی به نام فشار بخار است. در شیمی ، فشار بخار فشاری است که دیواره های یک ظرف بسته هنگام تبخیر ماده شیمیایی موجود در آن (تبدیل به گاز) می شود. برای یافتن فشار بخار در دمای معین ، از معادله Clausius-Clapeyron استفاده کنید: ln (P1/P2) = (ΔHبخار/R) ((1/T2) - (1/T1)).
گام
روش 1 از 3: با استفاده از معادله Clausius-Clapeyron
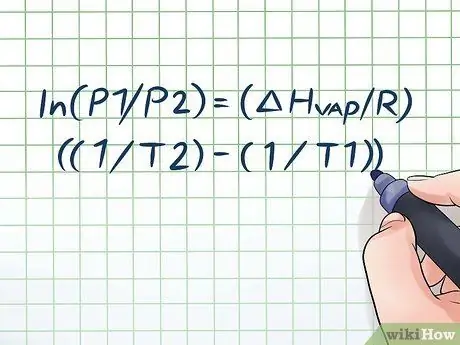
مرحله 1. معادله Clausius-Clapeyron را بنویسید
فرمولی که برای محاسبه فشار بخار با تغییر فشار بخار در طول زمان استفاده می شود ، معادله Clausius -Clapeyron نامیده می شود (به نام فیزیکدانان رودولف کلاسیوس و Benoît Paul mile Clapeyron نامگذاری شده است). سوالات فشار بخار اغلب در کلاسهای فیزیک و شیمی یافت می شود. فرمول به این صورت است: ln (P1/P2) = (ΔHبخار/R) ((1/T2) - (1/T1)) به در این فرمول ، متغیرها نشان دهنده موارد زیر هستند:
-
حبخار:
آنتالپی تبخیر مایع. این آنتالپی را معمولاً می توان در جدول پشت کتاب درسی شیمی یافت.
-
R:
ثابت گاز واقعی/جهانی ، یا 8.314 J/(K × Mol).
-
Q1:
دمایی که فشار بخار در آن مشخص است (یا دمای اولیه).
-
T2:
دمایی که در آن فشار بخار ناشناخته است/می خواهید (یا دمای نهایی) پیدا شود.
-
P1 و P2:
فشار بخار در دمای T1 و T2 به ترتیب.

مرحله 2. متغیرهایی را که می شناسید وارد کنید
معادله Clausius-Clapeyron پیچیده به نظر می رسد زیرا دارای متغیرهای مختلف زیادی است ، اما اگر اطلاعات صحیح را داشته باشید ، واقعاً چندان دشوار نیست. در بیشتر مشکلات اساسی فشار بخار دو مقدار دما و یک مقدار فشار یا دو مقدار فشار و یک مقدار دما ذکر می شود - هنگامی که به این نتیجه رسیدید ، حل این معادله بسیار آسان است.
- به عنوان مثال ، بگویید که به ما گفته می شود ظرفی پر از مایع در 295 K داریم که فشار بخار آن 1 اتمسفر (اتمسفر) است. س Ourال ما این است: فشار بخار در 393 K چقدر است؟ ما دو مقدار دما و یک مقدار فشار داریم ، بنابراین می توانیم مقادیر فشار دیگر را با استفاده از معادله Clausius-Clapeyron پیدا کنیم. با وارد کردن متغیرهای خود ، به نتیجه می رسیم ln (1/P2) = (ΔHبخار/R) ((1/393) - (1/295)).
- توجه داشته باشید که برای معادله Clausius-Clapeyron ، همیشه باید از مقدار دما استفاده کنید کلوین به تا زمانی که مقادیر P1 و P2 یکسان باشند ، می توانید از هر مقدار فشار استفاده کنید.

مرحله 3. ثابت های خود را وارد کنید
معادله Clausius-Clapeyron دارای دو ثابت است: R و Hبخاربه R همیشه برابر 8.314 J/(K × Mol) است. با این حال ، حبخار (آنتالپی تبخیر) بستگی به ماده ای دارد که فشار بخار آن را دنبال می کنید. همانطور که در بالا ذکر شد ، معمولاً می توانید مقادیر H را پیدا کنیدبخار برای مواد مختلف در پشت کتاب درسی شیمی یا فیزیک یا به صورت آنلاین (مانند ، برای مثال ، اینجا)
-
در مثال ما ، فرض کنید مایع ما است آب خالص.
اگر در جدول به مقادیر H نگاه کنیمبخار، در می یابیم که Hبخار آب خالص حدود 40.65 کیلوژول بر مول است. از آنجا که مقدار H ما به ژول است ، و نه کیلوژول ، ما می توانیم آن را به تبدیل کنیم 40،650 J/mol.
- با اتصال ثابت های خود ، دریافت می کنیم ln (1/P2) = (40،650/8، 314) ((1/393) - (1/295)).
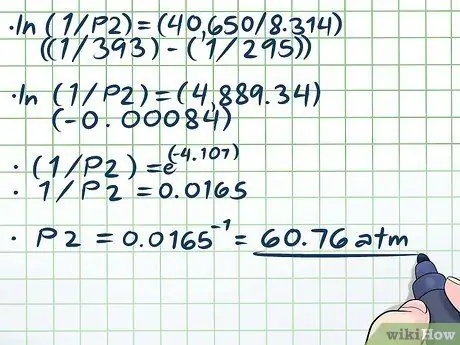
مرحله 4. معادله را حل کنید
وقتی همه متغیرها را در معادله وارد کردید به جز موردی که به دنبال آن هستید ، طبق قوانین جبر معمولی به حل معادله بپردازید.
-
تنها بخش دشوار حل معادله ما (ln (1/P2) = (40،650/8، 314) ((1/393) - (1/295))) در حال برطرف کردن log طبیعی (ln) است. برای حذف log طبیعی ، فقط از دو طرف معادله به عنوان نمرات ثابت ریاضی e استفاده کنید. به عبارت دیگر، ln (x) = 2 → eln (x) = e2 → x = e2.
- حال ، معادله خود را حل می کنیم:
- ln (1/P2) = (40،650/8، 314) ((1/393) - (1/295))
- ln (1/P2) = (4889 ، 34) (-0 ، 00084)
- (1/P2) = e(-4, 107)
- 1/P2 = 0.0165
-
P2 = 0.0165-1 = 60 ، 76 اتمسفر
این منطقی است - در یک ظرف بسته ، افزایش دما تا تقریباً 100 درجه (تقریباً 20 درجه بالاتر از نقطه جوش) بخار زیادی تولید می کند و فشار را به سرعت افزایش می دهد.
روش 2 از 3: یافتن فشار بخار با محلول محلول
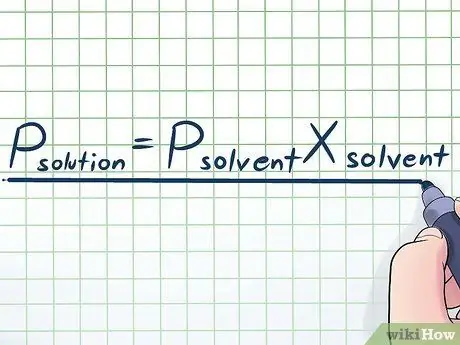
مرحله 1. قانون رائولت را بنویسید
در زندگی واقعی ، ما به ندرت با یک مایع خالص کار می کنیم - معمولاً ما با مایعی کار می کنیم که مخلوطی از چندین ماده مختلف است. برخی از متداول ترین مخلوط ها با حل کردن مقدار کمی از یک ماده شیمیایی خاص به نام املاح در بسیاری از مواد شیمیایی به نام حلال برای ساختن محلول ساخته می شوند. در این موارد ، دانستن معادله ای به نام قانون رائولت (به نام فیزیکدان فرانسوا ماری راولت) مفید است که به این صورت نوشته شده است: پحل شونده= Pحلالایکسحلال به در این فرمول ، متغیرها نشان دهنده؛
-
پحل شونده:
فشار بخار کل محلول (همه عناصر ترکیب شده)
-
پحلال:
فشار بخار حلال
-
ایکسحلال:
کسر مول حلال
- اگر اصطلاحاتی مانند کسر خال را نمی شناسید نگران نباشید - ما آنها را در چند مرحله بعدی توضیح می دهیم.

مرحله 2. حلال و املاح موجود در محلول خود را تعیین کنید
قبل از اینکه بتوانید فشار بخار یک مایع مخلوط را محاسبه کنید ، باید موادی را که استفاده می کنید مشخص کنید. برای یادآوری ، وقتی محلول در حلال حل می شود ، محلول تشکیل می شود - ماده شیمیایی که حل می شود همیشه حلال نامیده می شود و ماده شیمیایی که باعث حل شدن آن می شود ، همیشه حلال نامیده می شود.
- بیایید با استفاده از مثال های ساده در این بخش مفاهیمی را که مورد بحث قرار می دهیم ، نشان دهیم. برای مثال ما ، فرض کنید می خواهیم فشار بخار شربت قند را پیدا کنیم. به طور سنتی ، شربت شکر قند محلول در آب (نسبت 1: 1) است ، بنابراین می توان گفت که شکر املاح ما و آب حلال ما است.
- توجه داشته باشید که فرمول شیمیایی ساکارز (شکر روی میز) C است12ح22O11به این فرمول شیمیایی بسیار مهم خواهد بود.
مرحله 3. دمای محلول را پیدا کنید
همانطور که در بخش Clausius Clapeyron در بالا دیدیم ، دمای مایع بر فشار بخار آن تأثیر می گذارد. به طور کلی ، هرچه درجه حرارت بالاتر باشد ، فشار بخار بیشتر است - با افزایش دما ، مایع بیشتری بخار شده و بخار تشکیل می شود و فشار را در ظرف افزایش می دهد.
در مثال ما ، فرض کنید دمای شربت قند در این مرحله برابر است 298 کیلوگرم (حدود 25 درجه سانتیگراد).
مرحله 4. فشار بخار حلال را پیدا کنید
مواد مرجع شیمیایی معمولاً دارای مقدار فشار بخار برای بسیاری از مواد و ترکیبات متداول هستند ، اما این مقادیر فشار معمولاً فقط در صورتی معتبر هستند که این ماده دارای دمای 25 درجه سانتیگراد/298 درجه سانتیگراد یا نقطه جوش آن باشد. اگر محلول شما یکی از این درجه حرارت ها را دارد ، می توانید از مقدار مرجع استفاده کنید ، اما در غیر این صورت ، باید فشار بخار را در آن دما پیدا کنید.
- Clausius -Clapeyron می تواند کمک کند - از فشار بخار مرجع و 298 K (25 درجه سانتی گراد) به ترتیب برای P1 و T1 استفاده کنید.
- در مثال ما ، دمای مخلوط ما 25 درجه سانتی گراد است ، بنابراین ما می توانیم به راحتی از جدول مرجع آسان خود استفاده کنیم. ما می دانیم که در دمای 25 درجه سانتی گراد ، آب دارای فشار بخار است 23.8 میلی متر جیوه

مرحله 5. کسر مول حلال خود را پیدا کنید
آخرین کاری که باید انجام دهیم این است که بخش مول حلال خود را پیدا کنیم. یافتن کسر خال آسان است: فقط ترکیبات خود را به خال تبدیل کنید ، سپس درصد هر ترکیب را در تعداد خال های ماده پیدا کنید. به عبارت دیگر ، کسر مول هر ترکیب برابر است (خال ترکیب)/(تعداد کل خال در ماده).
-
فرض کنید دستورالعمل استفاده از شربت قند ما است 1 لیتر (L) آب و 1 لیتر ساکارز (شکر).
در این مورد ، ما باید تعداد مول هر ترکیب را پیدا کنیم. برای انجام این کار ، جرم هر ترکیب را پیدا می کنیم ، سپس از جرم مولی ماده برای تبدیل آن به مول استفاده می کنیم.
- جرم (1 لیتر آب): 1000 گرم (گرم)
- جرم (1 لیتر شکر خام): تقریباً 1،056 ، 8 گرم
- خال (آب): 1000 گرم × 1 مول/18.015 گرم = 55.51 مول
- خال (ساکارز): 1.056 ، 7 گرم × 1 مول/342.2965 گرم = 3.08 مول (توجه داشته باشید که می توانید جرم مولی ساکارز را از فرمول شیمیایی آن ، C پیدا کنید.12ح22O11.)
- خال کل: 55.51 + 3.08 = 58.59 مول
- کسر مول آب: 55 ، 51/58 ، 59 = 0, 947
مرحله 6. تمام کنید
در نهایت ، ما همه چیزهایی را که برای حل معادله قانون رائولت نیاز داریم در اختیار داریم. این قسمت بسیار آسان است: فقط مقادیر خود را برای متغیرهای موجود در معادله ساده شده قانون Raoult در ابتدای این بخش وارد کنید (پحل شونده = Pحلالایکسحلال).
- با وارد کردن ارزش های خود ، به دست می آوریم:
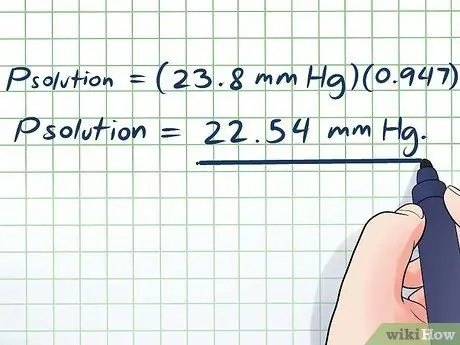
- پراه حل = (23.8 میلی متر جیوه) (0 ، 947)
-
پراه حل = 22.54 میلی متر جیوه
نتیجه منطقی است - از نظر مول ، قند بسیار کمی در آب زیادی حل شده است (هر چند در شرایط واقعی ، هر دو ماده دارای حجم یکسانی هستند) ، بنابراین فشار بخار فقط کمی کاهش می یابد.
روش 3 از 3: یافتن فشار بخار در موارد خاص

مرحله 1. مراقب شرایط استاندارد دما و فشار باشید
دانشمندان اغلب از مجموعه مقادیر دما و فشار به عنوان یک "استاندارد" آسان برای استفاده استفاده می کنند. این مقادیر دما و فشار استاندارد (یا STP) نامیده می شوند. مشکلات فشار بخار اغلب به شرایط STP اشاره دارد ، بنابراین به خاطر سپردن این مقادیر مهم است. مقادیر STP به شرح زیر تعریف می شود:
- درجه حرارت: 273 ، 15 کیلوگرم / 0 C / 32 اف
- فشار: 760 میلی متر جیوه / 1 اتمسفر / 101 ، 325 کیلوپاسکال

مرحله 2. معادله Clausius-Clapeyron را برای یافتن سایر متغیرها دوباره تنظیم کنید
در مثال ما در قسمت 1 ، دیدیم که معادله Clausius -Clapeyron برای یافتن فشار بخار برای مواد خالص بسیار مفید است. با این حال ، همه سوالات از شما نمی خواهند که به دنبال P1 یا P2 باشید - بسیاری از شما می خواهند مقدار دما یا گاهی اوقات حتی مقدار H را پیدا کنید.بخاربه خوشبختانه ، در این موارد ، درست دریافتن فقط به معنای تغییر مجدد معادله است به طوری که متغیرهایی که می خواهید حل کنید در یک طرف علامت مساوی جدا هستند.
- برای مثال ، بگویید ما یک مایع ناشناخته با فشار بخار 25 torr در 273 K و 150 torr در 325 K داریم و می خواهیم انتالپی بخار شدن این مایع را پیدا کنیم (ΔHبخار) ما می توانیم اینگونه حل کنیم:
- ln (P1/P2) = (ΔHبخار/R) ((1/T2) - (1/T1))
- (ln (P1/P2))/((1/T2) - (1/T1)) = (ΔHبخار/R)
- R × (ln (P1/P2))/((1/T2) - (1/T1)) = Hبخار اکنون ، مقادیر خود را وارد می کنیم:
- 8 ، 314 J/(K × Mol) (-1 ، 79)/(-0 ، 00059) = Hبخار
- 8 ، 314 J/(K × Mol) 0 3،033 ، 90 = Hبخار = 25،223 ، 83 J/mol

مرحله 3. هنگامی که ماده بخار تولید می کند ، فشار بخار محلول را محاسبه کنید
در مثال قانون رائولت ما در بالا ، املاح ما ، قند ، به تنهایی در دمای معمولی هیچ فشاری وارد نمی کند (فکر کنید - آخرین باری که دیدید یک کاسه قند در کمد بالایی شما تبخیر شده است کی بوده است؟) با این حال ، وقتی املاح شما تبخیر می شود ، این بر فشار بخار شما تأثیر می گذارد. ما با استفاده از نسخه اصلاح شده معادله قانون رائولت این امر را محاسبه می کنیم: پراه حل = (صترکیبایکسترکیب) نماد سیگما (Σ) به این معنی است که ما فقط باید تمام فشارهای بخار ترکیبات مختلف را جمع کنیم تا پاسخ خود را بدست آوریم.
- به عنوان مثال ، بگویید که ما یک محلول ساخته شده از دو ماده شیمیایی داریم: بنزن و تولوئن. حجم کل محلول 12 میلی لیتر (میلی لیتر) است. 60 میلی لیتر بنزن و 60 میلی لیتر تولوئن. دمای محلول 25 درجه سانتی گراد است و فشارهای بخار هر یک از این مواد شیمیایی در دمای 25 درجه سانتی گراد برای بنزن 95.1 میلی متر جیوه و برای تولوئن 28.4 میلی متر جیوه است. با این مقادیر ، فشار بخار محلول را بیابید. ما می توانیم این کار را با استفاده از چگالی استاندارد ، جرم مولی و فشار بخار برای دو ماده شیمیایی خود به شرح زیر انجام دهیم:
- جرم (بنزن): 60 میلی لیتر = 0.060 لیتر و زمان 876.50 کیلوگرم/1000 لیتر = 0.053 کیلوگرم = 53 گرم
- جرم (تولوئن): 0.060 لیتر و زمان 866 ، 90 کیلوگرم/1000 لیتر = 0.052 کیلوگرم = 52 گرم
- مول (بنزن): 53 گرم × 1 مول/78 ، 11 گرم = 0.679 مول
- خال (تولوئن): 52 گرم × 1 مول/92 ، 14 گرم = 0.564 مول
- خال های کل: 0.679 + 0.564 = 1.243 =
- کسر مول (بنزن): 0.679/1 ، 243 = 0.546
- کسر مول (تولوئن): 0.564/1 ، 243 = 0.454
- راه حل: Pراه حل = Pبنزنایکسبنزن + پتولوئنایکستولوئن
- پراه حل = (95.1 میلی متر جیوه) (0 ، 546) + (28.4 میلی متر جیوه) (0 ، 454)
- پراه حل = 51.92 میلی متر جیوه + 12.89 میلی متر جیوه = 64 ، 81 میلی متر جیوه
نکات
- برای استفاده از معادله Clausius Clapeyron در بالا ، دما باید بر حسب کلوین اندازه گیری شود (به صورت K نوشته شده است). اگر درجه حرارت را در درجه سانتیگراد دارید ، باید آن را با استفاده از فرمول زیر تبدیل کنید: تیک = 273 + Tج
- از روشهای فوق می توان استفاده کرد زیرا انرژی دقیقاً متناسب با مقدار گرمای اعمال شده است. دمای مایع تنها عامل محیطی است که بر فشار بخار تأثیر می گذارد.







