اگر به نظر می رسد جدول تناوبی گیج کننده است و درک آن دشوار است ، نگران نباشید ، شما تنها نیستید! درک نحوه عملکرد جدول تناوبی می تواند مشکل باشد ، اما با یادگیری نحوه خواندن آن ، در علم موفق خواهید شد. با درک ساختار جدول تناوبی و اطلاعاتی که در مورد عناصر نشان می دهد ، شروع کنید. در مرحله بعد ، می توانید هر یک از عناصر را مطالعه کنید. در نهایت ، از اطلاعات ذکر شده در جدول تناوبی برای پیدا کردن تعداد نوترونهای یک اتم استفاده کنید.
گام
قسمت 1 از 3: درک ساختار جدول تناوبی
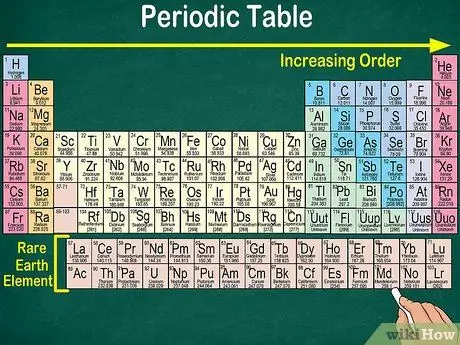
مرحله 1. جدول تناوبی را از بالا به چپ به پایین راست بخوانید
عناصر با توجه به تعداد اتمی آنها مرتب شده اند. هرچه به سمت راست و پایین باشد ، عدد اتمی بیشتر است. عدد اتمی تعداد پروتون هایی است که اتم یک عنصر دارد. با جلوتر رفتن به سمت راست ، متوجه خواهید شد که تعداد جرم هر اتم افزایش می یابد. به این معنا که می توانید وزن یک عنصر را حتی با نگاه کردن به موقعیت آن روی میز درک کنید.
- به سمت راست یا پایین ، جرم اتمی عنصر افزایش می یابد زیرا جرم اتمی با جمع پروتون ها و نوترون ها در هر اتم عنصر محاسبه می شود. تعداد پروتون ها با عنصر افزایش می یابد ، به این معنی که وزن آن نیز افزایش می یابد.
- الکترونها در جرم اتمی گنجانده نمی شوند زیرا در مقایسه با پروتونها و نوترونها ، الکترونها تأثیر زیادی بر وزن اتمی ندارند.

مرحله 2. درک کنید که هر عنصر شامل 1 پروتون بیشتر از اتم سمت چپ آن است
با مشاهده عدد اتمی می توانید این را تشخیص دهید. اعداد اتمی از چپ به راست مرتب شده اند. عناصر نیز به 3 گروه تقسیم می شوند ، می توانید گروه بندی را در جدول مشاهده کنید.
به عنوان مثال ، ردیف اول هیدروژن را که دارای عدد اتمی 1 است و هلیوم را که دارای عدد اتمی 2 است ، فهرست می کند. با این حال ، این دو عنصر در سمت چپ و راست جدول قرار دارند زیرا در گروه های مختلف قرار دارند
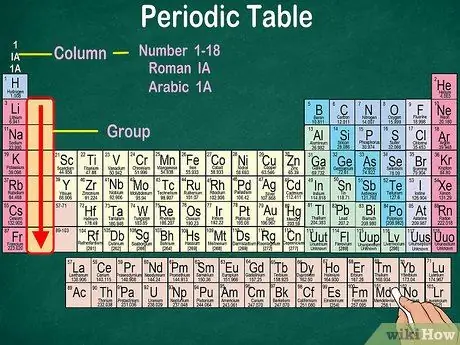
مرحله 3. گروههای اتمها را مشخص کنید که دارای خواص فیزیکی و شیمیایی یکسانی هستند
گروه ها با ستون های عمودی نشان داده می شوند. در بیشتر موارد ، گروه ها با همان رنگ مشخص می شوند. این به شما کمک می کند مشخص کنید کدام عناصر دارای خواص فیزیکی و شیمیایی مشابه هستند. این امر پیش بینی واکنش این عناصر را برای شما آسان تر می کند. هر عنصر در یک گروه معین دارای تعداد یکسانی الکترون در بیرونی ترین مدار خود است.
- اکثر عناصر فقط به یک گروه تعلق دارند. با این حال ، هیدروژن را می توان به عنوان هالوژن یا فلز قلیایی طبقه بندی کرد. در برخی از جداول ، هیدروژن در هر دو گروه ظاهر می شود.
- در بیشتر موارد ، ستون ها در بالا یا پایین جدول شماره 1-18 خواهند داشت. اعداد را می توان با اعداد رومی (IA) ، اعداد عربی (1A) یا اعداد (1) نمایش داد.
- گروه های اتمی را از بالا به پایین بخوانید.
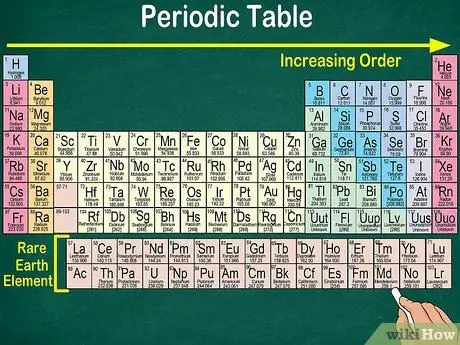
مرحله 4. به فضای خالی جدول توجه کنید
علاوه بر عدد اتمی ، چیدمان عناصر در گروه ها و گروه ها نیز خواص فیزیکی و شیمیایی یکسانی را در نظر می گیرد. به این ترتیب ، نحوه واکنش هر عنصر را بهتر درک خواهید کرد. افزودن عناصر شیمیایی طبقه بندی آنها را دشوارتر می کند ، بنابراین تعجب آور نیست که جدول تناوبی دارای فضای خالی باشد.
- به عنوان مثال ، 3 ردیف اول دارای فضاهای خالی است ، زیرا فلزات انتقالی که در جدول ظاهر می شوند ، عناصری هستند که دارای عدد اتمی 21 هستند.
- به طور مشابه ، عناصر 57 تا 71 ، که عناصر کمیاب خاک یا عناصر کمیاب خاک هستند ، جداگانه در پایین سمت راست جدول نشان داده شده است.
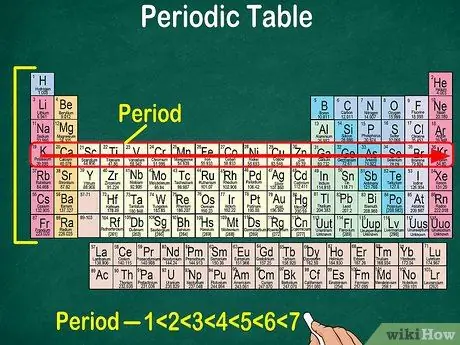
مرحله 5. توجه داشته باشید که هر ردیف نقطه نامیده می شود
همه عناصر در یک دوره دارای تعداد یکسان مداری اتمی هستند که الکترونها از طریق آنها عبور می کنند. تعداد مداری با تعداد دوره ها مطابقت دارد. جدول تناوبی 7 ردیف را نشان می دهد ، یعنی 7 دوره وجود دارد.
- به عنوان مثال ، یک عنصر در دوره 1 دارای 1 مداری است ، در حالی که یک عنصر در دوره 7 دارای 7 مداری است.
- در بیشتر موارد ، دوره ها 1-7 از بالا به پایین در سمت چپ جدول شماره گذاری می شوند.
- دوره عناصر زیر ردیف را از چپ به راست بخوانید.
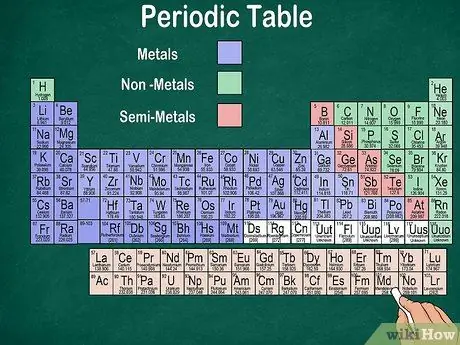
مرحله 6. بین فلزات ، نیمه فلزات و غیرفلزات تمایز قائل شوید
با شناخت نوع عنصر می توانید ویژگی های عناصر را بهتر درک کنید. خوشبختانه اکثر جدول تناوبی از رنگ برای نشان دادن فلز ، نیمه فلز یا غیر فلز بودن رنگ استفاده می کنند. عناصر فلزی را در سمت راست میز و غیر فلزات را در سمت چپ پیدا خواهید کرد. گروه نیمه فلزی بین فلزات و غیر فلزات قرار دارد.
- به خاطر داشته باشید که هیدروژن را می توان با هالوژن ها یا فلزات قلیایی به دلیل خواص آن گروه بندی کرد. بنابراین طبیعی است که هیدروژن در دو طرف میز ظاهر شود یا رنگ متفاوتی داشته باشد.
- اگر یک عنصر براق ، جامد در دمای اتاق ، حرارت و الکتریسیته و نرم و کشسان باشد ، فلز نامیده می شود.
- اگر یک عنصر براق نباشد ، گرما یا الکتریسیته را هدایت نکند و سخت باشد ، یک غیر فلز محسوب می شود. این عناصر معمولاً در دمای اتاق گازی هستند ، اما در دمای خاصی نیز می توانند جامد یا مایع باشند.
- اگر یک عنصر دارای ویژگیهای ترکیبی فلز و غیر فلز باشد ، نیم فلز نامیده می شود.
قسمت 2 از 3: مطالعه عناصر
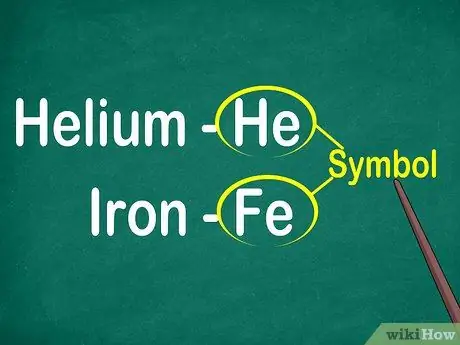
مرحله 1. نمادهای 1 تا 2 عنصر حرف را مشخص کنید
نماد معمولاً در مرکز یک مربع با فونت بزرگ قرار دارد. نمادها مخفف نام عناصر هستند که در زبانهای مختلف استاندارد شده اند. هنگام انجام آزمایش یا کار بر روی معادلات عنصری ، احتمالاً از نمادهای عنصر استفاده خواهید کرد. بنابراین ، بخواهید یا نخواهید ، باید خود را با نمادهای اساسی آشنا کنید.
نمادها معمولاً از نام لاتین عنصر گرفته شده اند ، اما گاهی اوقات از نامهایی که به طور گسترده استفاده می شوند ، به ویژه عناصر جدید ، گرفته شده است. به عنوان مثال ، نماد هلیوم He است که مخفف این نام معروف است. با این حال ، نماد آهن Fe است که تشخیص آن در نگاه اول نسبتاً دشوار است

مرحله 2. در صورت وجود ، نام کامل عنصر را بیابید
این نام عنصری است که در صورت نیاز به نوشتن کامل از آن استفاده خواهید کرد. به عنوان مثال ، "هلیوم" و "کربن" نام عناصر هستند. در بیشتر موارد ، نام عنصر در زیر نماد قرار دارد ، اما محل قرار گیری می تواند متفاوت باشد.
برخی از جداول تناوبی ممکن است نام کامل نداشته باشند و فقط از نمادها استفاده کنند
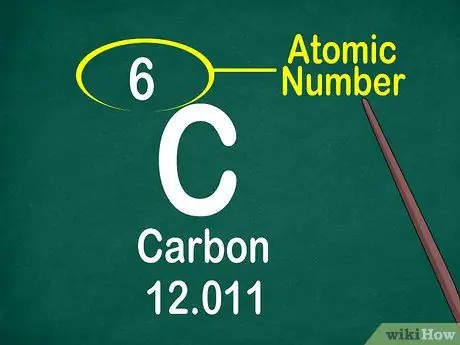
مرحله 3. به عدد اتمی توجه کنید
عدد اتمی معمولاً در بالای جعبه ، در وسط یا گوشه جعبه قرار دارد. با این حال ، عدد اتمی همچنین می تواند تحت نماد عنصر یا نام عنصر قرار گیرد. اعداد اتمی از 1-118 مرتب شده اند.
عدد اتمی یک عدد صحیح است نه اعشاری
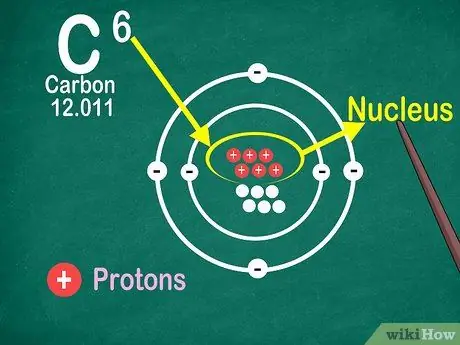
مرحله 4. بدانید که عدد اتمی ، تعداد پروتون های اتم است
تمام اتم های یک عنصر دارای تعداد پروتون یکسانی هستند. برخلاف الکترون ها ، پروتون ها نمی توانند توسط اتم ها اسیر یا آزاد شوند. اگر اتم ها بتوانند اتم ها را بگیرند یا از دست بدهند ، عناصر تغییر خواهند کرد.
همچنین برای یافتن تعداد الکترون ها و نوترون ها به عدد اتمی نیاز دارید
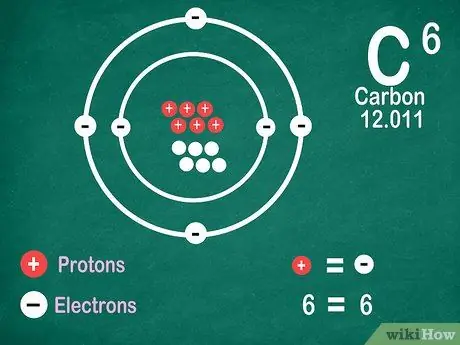
مرحله 5. بدانید که عناصر دارای تعداد الکترونهای مشابه پروتونها هستند ، مگر اینکه عنصر تحت یونیزاسیون قرار گیرد
پروتون ها دارای بار مثبت و الکترون ها دارای بار منفی هستند. از آنجایی که یک اتم خنثی بار الکتریکی ندارد ، به این معنی است که تعداد الکترون ها و پروتون های یکسانی دارد. با این حال ، اتم ها می توانند الکترون ها را از دست داده و به دست آورند ، که آنها را یونیزه می کند.
- یونها بارهای الکتریکی هستند. اگر پروتون های بیشتری در یون وجود داشته باشد ، بار مثبت است که در کنار نماد یون علامت مثبت (+) است. اگر تعداد الکترونهای یون بیشتر باشد ، بار منفی است که منفی است (-).
- اگر اتم یک یون نباشد ، علامت مثبت یا منفی را مشاهده نخواهید کرد.
قسمت 3 از 3: استفاده از وزن اتمی برای شمارش نوترون ها

مرحله 1. وزن اتمی را بشناسید
وزن اتمی معمولاً در پایین جعبه ، زیر نماد عنصر قرار دارد. وزن اتمی وزن ترکیبی ذرات موجود در هسته اتمی شامل پروتون ها و نوترون ها است. با این حال ، یون ها می توانند روند شمارش را پیچیده کنند. بنابراین ، وزن اتمی نشان دهنده میانگین جرم اتمی عنصر و جرم اتمی یونهای آن است.
- به دلیل متوسط وزن ، اکثر اتمها دارای وزن اتمی به صورت اعشاری هستند.
- اگرچه وزن یک عنصر به نظر می رسد که از چپ به راست افزایش می یابد ، اما همیشه اینطور نیست.
مرحله 2. عدد جرمی عنصری را که در حال مطالعه آن هستید تعیین کنید
با گرد کردن جرم اتمی می توانید عدد جرم را بیابید. این واقعیت ثابت می کند که وزن اتمی میانگین کل جرم اتمی ، از جمله یون ها است.
به عنوان مثال ، وزن اتمی کربن 12،011 است ، بنابراین تا 12 عدد گرد می شود. به همین ترتیب ، وزن اتمی آهن 55/847 است بنابراین تا 56 گرد می شود
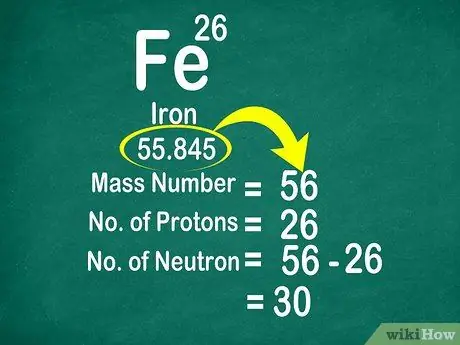
مرحله 3. برای شمارش نوترونها عدد جرمی را از عدد اتمی کم کنید
عدد جرمی را می توان با افزودن تعداد پروتون به تعداد نوترون ها محاسبه کرد. با محاسبه تعداد جرم از تعداد پروتون ها ، محاسبه تعداد نوترون های یک اتم برای شما آسان تر می شود.
- از این فرمول استفاده کنید: نوترون = تعداد جرم - پروتون
- به عنوان مثال ، جرم کربن 12 است و 6 پروتون دارد. بنابراین ، ما می توانیم بدانیم که کربن دارای 6 نوترون است زیرا 12 - 6 = 6.
- مثال دیگر ، تعداد جرم آهن 56 و دارای 26 پروتون است. بنابراین ، ما می دانیم که آهن دارای 30 نوترون است زیرا 56 - 26 = 30.
- ایزوتوپهای اتمها دارای تعداد متفاوتی از نوترونها هستند بنابراین وزن اتمی آنها تغییر می کند.
نکات
- خواندن جدول تناوبی برای برخی از افراد دشوار است. اگر مطالعه جدول تناوبی برای شما مشکل است ناامید نشوید!
- رنگهای جدول ممکن است متفاوت باشد ، اما محتوا ثابت است.
- برخی از جدول های تناوبی ممکن است اطلاعات ناقص را ارائه دهند. به عنوان مثال ، برخی از جداول فقط نماد و عدد اتمی را نشان می دهند. برای آن ، به دنبال میز مناسب با نیازهای خود باشید!







