رقیق سازی فرآیند رقیق تر شدن محلول غلیظ است. دلایل مختلفی وجود دارد که چرا ممکن است کسی بخواهد رقیق کننده انجام دهد ، از دلایل جدی گرفته تا دلایل ساده. به عنوان مثال ، بیوشیمیست ها محلول ها را از فرم غلیظ خود رقیق می کنند تا محلول های جدیدی برای استفاده در آزمایش ایجاد کنند ، در حالی که از طرف دیگر ، متصدیان بارها مشروب را با نوشابه یا آب میوه رقیق می کنند تا کوکتل ها خوشمزه تر شوند. فرمول کلی محاسبه رقت عبارت است از: ج1V1 = ج2V2 ، با سی1 و سی2 به ترتیب نشان دهنده غلظت اولیه و نهایی محلول و V است1 و V2 حجم را نشان می دهد
گام
روش 1 از 2: رقیق سازی دقیق کنسانتره ها از طریق معادله رقت

مرحله 1. آنچه را که می دانید و نمی دانید تعیین کنید
رقیق سازی در شیمی معمولاً به این معنی است که مقدار کمی از محلول مورد نظر خود را با غلظت آن ، سپس یک مایع خنثی (مانند آب) اضافه کنید تا محلول جدیدی با حجم بیشتر اما غلظت کمتر تولید شود. این اغلب در آزمایشگاههای شیمی انجام می شود ، زیرا به منظور اثر بخشی ، اغلب معرفها در غلظتهای بسیار بالا ذخیره می شوند ، که سپس برای استفاده در آزمایشها رقیق می شوند. معمولاً ، در بیشتر موقعیت های واقعی ، غلظت محلول اولیه و غلظت یا حجمی را که می خواهید غلظت نهایی شما باشد ، می دانید ، اما حجم محلول اولیه ای را که برای به دست آوردن محلول نهایی نیاز دارید ، نمی دانید.
- با این حال ، در شرایط دیگر (به ویژه در مشکلات مدرسه) ، ممکن است لازم باشد قطعات دیگری از پازل را پیدا کنید - برای مثال ، ممکن است حجم و غلظت اولیه به شما داده شود ، سپس در صورت رقیق کردن محلول ، از شما خواسته می شود تا غلظت نهایی را پیدا کنید. به حجم دلخواه در هر صورت رقت ، توجه به متغیرهای شناخته شده و ناشناخته قبل از شروع مفید است.
-
اجازه دهید نمونه سوالات را به پایان برسانیم. فرض کنید از ما خواسته شده است که یک محلول 5 میلی متری را با آب رقیق کنیم تا 1 لیتر از یک محلول 1 حاصل شود میلی متر به در این حالت ، ما غلظت محلول اولیه خود و حجم و غلظت نهایی مورد نظر خود را می دانیم ، اما مقدار محلول اولیه ای را که باید با آب اضافه کنیم تا به نتیجه دلخواه برسیم ، نمی دانیم.
یادآوری: در شیمی ، M اندازه گیری غلظت موسوم به Molarity است که خال های یک ماده در لیتر را نشان می دهد
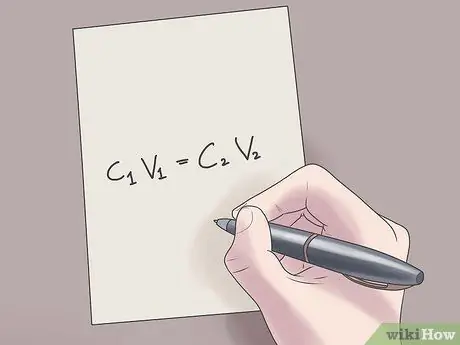
مرحله 2. مقادیر خود را به فرمول C وصل کنید1V1 = ج2V2.
در این فرمول ، سی1 غلظت اولیه محلول ، V است1 حجم محلول اولیه ، C است2 غلظت نهایی محلول است و V2 حجم محلول نهایی است. افزودن مقادیر شناخته شده به این معادله به شما کمک می کند تا مقادیر ناشناخته را با دشواری کمتری پیدا کنید.
- شاید برای شما مفید باشد که علامت س questionال را در جلوی واحدی که می خواهید جستجو کنید قرار دهید تا به شما در حل آن کمک کند.
-
بیایید مثال خود را ادامه دهیم. مقادیری را که می شناسیم به شرح زیر وارد می کنیم:
- ج1V1 = ج2V2
- (5 متر) V1 = (1 میلی مولار) (1 لیتر). دو غلظت ما واحدهای متفاوتی دارند. بیایید اینجا را متوقف کنیم و به مرحله بعدی برویم.

مرحله 3. هرگونه تفاوت واحد را در نظر بگیرید
از آنجا که راه حل ها شامل تغییر در غلظت (که گاهی اوقات می تواند بسیار بزرگ باشد) نیز نیست ، این دو متغیر در معادله شما واحدهای متفاوتی دارند. در حالی که نادیده گرفتن این امر آسان است ، واحدهای نابرابر در معادله شما می توانند باعث شوند که پاسخ شما نادرست باشد. قبل از اتمام ، همه مقادیر را با غلظت و/یا واحد حجم مختلف تبدیل کنید.
-
در مثال ما ، از واحدهای مختلف برای غلظت M (مولر) و mM (میلی مولر) استفاده می کنیم. بیایید اندازه گیری دوم خود را به M تغییر دهیم:
- 1 میلی متر × 1 میلی متر/1000 میلی مولار
- = 0.001 متر

مرحله 4. پایان دهید
وقتی همه واحدها برابر شدند ، معادله خود را حل کنید. تقریباً همیشه می توان این کار را با جبر ساده انجام داد.
-
مشکل مثال خود را در اینجا متوقف می کنیم: (5 M) V1 = (1 میلی مولار) (1 لیتر). بیایید مقدار V را پیدا کنیم1 با واحد جدید ما
- (5 متر) V1 = (0.001 متر) (1 لیتر)
- V1 = (0.001 M) (1 L)/(5 M)
-
V1 = 0.0002 لیتر یا 0.2 میلی لیتر

مرحله 5. نحوه استفاده صحیح از پاسخ خود را درک کنید
فرض کنید مقدار از دست رفته خود را پیدا کرده اید ، اما مطمئن نیستید که چگونه از این اطلاعات جدید در رقیق سازی واقعی که باید انجام دهید استفاده کنید. این قابل درک است - زبان ریاضی و علوم گاهی با دنیای واقعی مطابقت ندارد. وقتی چهار مقدار معادله C را بدانید1V1 = ج2V2، رقیق سازی را به شرح زیر انجام دهید:
- حجم V را اندازه بگیرید1 از محلول با غلظت C1به سپس ، رقیق کننده کافی (آب و غیره) را اضافه کنید تا حجم کل V حاصل شود2به این محلول جدید دارای غلظت مورد نظر شما خواهد بود (C2).
- در مثال ما ، برای مثال ، ابتدا 0.2 میلی لیتر از محلول 5 میلیمتری را اندازه گیری می کنیم. سپس ، آب کافی برای افزودن حجم محلول به 1 لیتر اضافه می کنیم: 1 لیتر - 0.0002 لیتر = 0.9998 لیتر ، یا 999 ، 8 میلی لیتر به به عبارت دیگر ، 999.8 میلی لیتر آب به محلول نمونه کوچک خود اضافه می کنیم. محلول جدید و رقیق شده ما دارای غلظت 1 میلی مولار است که غلظت مورد نظر ما است.
روش 2 از 2: ساختن محلول رقیق سازی ساده و کاربردی

مرحله 1. بسته بندی را برای اطلاعات بخوانید
دلایل مختلفی وجود دارد که ممکن است بخواهید محلول رقیق کننده را در خانه ، آشپزخانه یا آزمایشگاه غیر شیمیایی دیگر تهیه کنید. به عنوان مثال ، تهیه آب پرتقال از یک کنسانتره ساده یک رقیق کننده است. در بسیاری از موارد ، محصولی که باید رقیق شود حاوی اطلاعاتی در مورد رقیق سازی است که باید در جایی روی بسته بندی قرار گیرد. آنها ممکن است دستورالعمل های دقیقی برای پیروی از آنها داشته باشند. در اینجا به دنبال مواردی هستید که در جستجوی اطلاعات هستید:
- حجم محصول استفاده شده
- حجم رقیق کننده استفاده شده
- نوع رقیق کننده مورد استفاده (معمولاً آب)
- دستورالعمل مخلوط کردن ویژه
- ممکن است اطلاعاتی در مورد غلظت دقیق مایع استفاده شده مشاهده نکنید. این اطلاعات برای مصرف کننده عادی مفید نیست.

مرحله 2. ماده ای که به عنوان رقیق کننده عمل می کند را به محلول غلیظ اضافه کنید
برای رقیق سازی های ساده خانگی ، مانند آنهایی که ممکن است در آشپزخانه درست کنید ، شما فقط باید قبل از شروع حجم کنسانتره ای که استفاده می کنید و غلظت نهایی تقریبی مورد نظر را بدانید. کنسانتره را با مقدار مناسب رقیق کننده رقیق کنید که بسته به حجم کنسانتره اولیه مورد استفاده تعیین می شود. زیر را ببینید:
- به عنوان مثال ، اگر بخواهیم 1 فنجان کنسانتره آب پرتقال را به 1/4 غلظت اولیه آن رقیق کنیم ، اضافه می کنیم 3 فنجان آب به کنسانتره مخلوط نهایی ما 1 فنجان کنسانتره در 4 فنجان مایع کامل - 1/4 غلظت اولیه آن خواهد داشت.
- در اینجا یک مثال پیچیده تر وجود دارد: اگر می خواهیم 2/3 فنجان کنسانتره را به 1/4 غلظت اولیه آن رقیق کنیم ، 2 فنجان آب اضافه می کنیم ، زیرا 2/3 فنجان برابر است با 1/4 برابر 2 و 2/3 فنجان مایع کامل
- مطمئن شوید که ماده خود را در یک ظرف به اندازه کافی اضافه کنید تا حجم نهایی مورد نظر شما را نگه دارد - یک کاسه بزرگ یا یک ظرف مشابه.

مرحله 3. حجم پودر را در بیشتر موارد نادیده بگیرید
افزودن پودر (مانند مخلوط نوشیدنی خاص) به مایع معمولاً رقیق محسوب نمی شود. تغییر حجم ناشی از افزودن مقدار کمی پودر به مایع معمولاً آنقدر کوچک است که قابل اغماض نیست. به عبارت دیگر ، هنگام اضافه کردن مقدار کمی پودر به یک مایع ، فقط پودر را به حجم نهایی مایعات مورد نظر خود اضافه کرده و مخلوط کنید.
هشدار
- از دستورالعمل های ایمنی ارائه شده توسط سازنده یا مورد نیاز شرکت خود پیروی کنید. اگر مجبورید محلول اسید را رقیق کنید ، این امر بسیار مهم است.
- کار با محلول های اسیدی ممکن است نیاز به اقدامات ایمنی و دستورالعمل های دقیق تری نسبت به محلول های غیر اسیدی داشته باشد.